食品、医药品行业
食品及医药品领域的海外可追溯性法律法规
除了诸如ISO9000/9001这类面向所有产品的品质管理标准,面向食品的HACCP,面向医药品的GMP等在全球范围内通用的规则以外,不同的国家及地区也会制定各自的可追溯性相关法律法规。
随着现代全球化的进展,要实现可追溯性,必须还要理解海外的法律法规,并采取相应措施。下面将以欧盟各国采用的“一般食品法”、美国的“生物恐怖法”等为例,介绍海外各国的食品及医药品相关法律法规。
HACCP(Hazard Analysis Critical Control Point)
HACCP是Hazard Analysis Critical Control Point的首字母缩写,在汉语中译为“危害分析临界控制点”。HACCP是联合国粮食及农业组织(Food and Agriculture Organization of the United Nations:FAO)与世界卫生组织(World Health Organization:WHO)的协作机构,食品法典(CODEX)委员会于1993年部分发布的,是一种在全球范围内被推广的食品卫生管理方法。
HACCP中规定的方法,针对从原材料进货到制造、加工、出货为止的所有阶段,对存在食物中毒等可能性的危险因子(Hazard)进行科学分析(Analysis),并对减少或消除这些危险因子所必需的临界控制点(Critical Control Point)进行安全管理。在日本,制定于1995年的“综合卫生管理制造过程”也吸收了HACCP的内容。
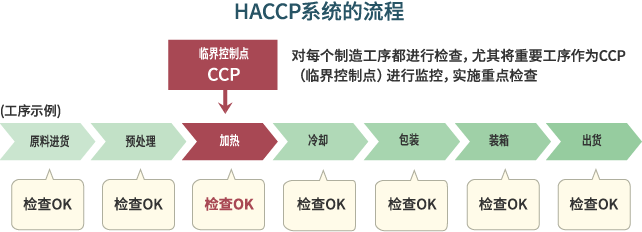
传统卫生管理与HACCP的区别
传统卫生管理中,只会对相关设施及设备的标准及食品的处理方法等进行规定,并通过对最终产品的检查确认食品安全性。而HACCP则会对各个工序中的危险因子进行分析,重点实施重要工序的相关管理,根据不同的制造过程分别制定标准,开展管理及检查。由于安全保障措施贯穿所有工序,能够有效预防食物中毒、异物混入等问题,切实提高食品安全性。

欧盟通用的食品可追溯性法律法规 一般食品法
在1996年发生BSE(疯牛病)问题之前,欧盟在食品领域并没有制定统一的管理标准。当时只是对不同品目的食品分别制定法规,再将各类法规汇编在一起。随着BSE问题的发生,这种状态的缺陷暴露无遗,于是欧盟在2002年制定了统一的“一般食品法(在制定食品法的通用原则及要件,以及食品安全相关的各项流程的同时,设立欧洲食品安全机构的法规(EC)No.178/2002)”。
同时明确了可追溯性的记录内容
关于可追溯性,一般食品法在第18条中做出了如下规定:“对于食品、饲料、食用动物及其他打算或预计要混合进食品或饲料的成分,均应建立涵盖生产、加工、流通全流程的可追溯性”。
同时还明确要求在食品供应链中,必须清晰留存以下信息,以供管理部门使用。此外,作为推荐采纳的条例,该法规还面向分量及数量等,设置了更为详尽的产品信息留存制度。
| 供应方 | 客户 |
|---|---|
| 姓名 | 姓名 |
| 所在地 | 所在地 |
| 供货产品的种类 | 进货产品的种类 |
| 交易及配送日期 | 交易及配送日期 |
美国的食品可追溯性相关法律法规 生物恐怖法
作为食品可追溯性法规,美国制定了“生物恐怖法(2002年公众健康安全和生物恐怖活动防范与应对法:The Public Health Security and Bioterrorism Preparedness and Response Act of 2002)”。
生物恐怖法中,在“商品相关设施注册”、“进口时事先申报”、“记录保存”、“行政拘留”等方面做出了硬性规定。其中与可追溯性关联性最高的,就是“记录保存”。
在记录保存方面,美国国内要求在进行食品的制造、加工、包装、流通、进货、储藏、出口时,必须明确记录上一流程的供货方及下一流程的进货方,并保存相关信息。此前已经在“识别体制的构建”中进行了说明,该法规中,对上一级及下一级工序的对应化提出了彻底的要求。此外,如果产品可能会对人类及动物的健康造成影响,必须将相关的记录及信息提交到美国食品药品监督管理局(Food and Drug Administration;:FDA)。
记录保存的期限
生物恐怖法规定,生产者应根据食品的易变质程度,设定保存期限。
| 分类 | 非运输者 | 运输者 |
|---|---|---|
| 会在60天以内变质的食品 | 6个月 | 6个月 |
| 会在60天至6个月以内变质的食品 | 1年 | 1年 |
| 能够保持6个月以上不变质的食品 | 2年 | 1年 |
| 动物饲料及宠物食品 | 1年 | 1年 |
中国的药品相关可追溯性法律法规 药品电子监管
中国负责保障食品、医药品安全的机构“国家食品药品监督管理局(China Food and Drug Administration:CFDA)”,自2016年正式开始实施药品电子监管码制度。凡在中国国内销售医药品,就必须获得经过CFDA认证的药品电子监管码,以条码形式记载有关信息。
药品电子监管码制度启用于2012年,其目的是防止医药品的错误使用,确保可追溯性,提高流通效率。此前仅在部分范围内实施,但从2016年起,要求包括海外企业在内的所有企业都必须使用。此外,必须将条码粘贴、打印到使用单位、个别的包装单位及外包装箱上。

药品电子监管码的构成说明

药品电子监管码由20位数字构成,采用Code128C的条码。
| 8 | 123456 | 123456789 | 1234 |
| 1 | 2 | 3 | 4 |
- 1. 固定数字、1位、“8”
- 2. 产品代码、6位,各类别及包装单位的类别代码,由管理机构(中国药品电子监管网)提供
- 3. 序列号、9位,在生产过程中,对生产企业不同产品采用的编号
- 4. 验证码、4位,验证用数据